La struttura dell'atomo. Modello quantum-meccanico di un atomo
Il seguente articolo descrive un atomoe la sua struttura: come è stato scoperto, come la teoria si è sviluppata nelle sue menti e durante gli esperimenti, i pensatori e gli scienziati. Il modello quantomeccanico dell'atomo come il più moderno oggi descrive completamente il suo comportamento e le particelle che compongono la composizione. Su di lei e le sue caratteristiche leggi qui sotto.
Il concetto di un atomo

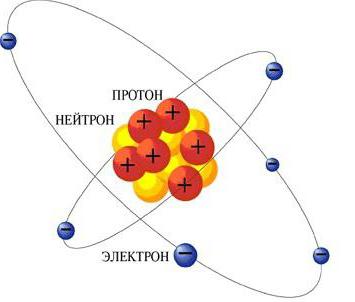
Un minimo chimicamente indivisibileUn elemento chimico con un insieme di caratteristiche caratteristiche di esso è un atomo. Include elettroni e un nucleo, che a sua volta contiene protoni carichi positivamente e neutroni non caricati. Se contiene lo stesso numero di protoni ed elettroni, allora l'atomo stesso sarà elettricamente neutro. Altrimenti, ha una carica: positiva o negativa. Allora l'atomo è chiamato lo ione. Quindi, la loro classificazione è effettuata: l'elemento chimico è determinato dal numero di protoni e dal suo isotopo da parte dei neutroni. Legandosi l'un l'altro sulla base di legami interatomici, gli atomi formano molecole.
Un po 'di storia

Per la prima volta, l'antico indiano eantichi filosofi greci. E durante il diciassettesimo e il diciottesimo secolo, i chimici hanno confermato l'idea, dimostrando sperimentalmente che alcune sostanze non possono essere scomposte nei loro elementi costitutivi attraverso esperimenti chimici. Tuttavia, dalla fine del diciannovesimo all'inizio del ventesimo secolo, i fisici scoprirono particelle subatomiche, che chiarirono che l'atomo non era indivisibile. Nel 1860, i chimici formularono i concetti di atomo e molecola, in cui l'atomo divenne la più piccola particella dell'elemento, che era una parte di sostanze sia semplici che complesse.
Modelli della struttura dell'atomo
- Pezzi di materia Democrito credeva che le proprietà delle sostanze possano essere determinate dalla massa, dalla forma e da altri parametri che caratterizzano gli atomi. Ad esempio, il fuoco ha atomi affilati, per cui ha la capacità di bruciare; I solidi contengono particelle ruvide, quindi sono strettamente legati l'uno all'altro; in acqua sono lisci, quindi ha la capacità di fluire. Secondo Democrito, anche l'anima umana è costituita da atomi.
- I modelli di Thomson. Lo scienziato considerava l'atomo come un corpo con una carica positiva, all'interno del quale ci sono gli elettroni. Questi modelli furono confutati da Rutherford, avendo condotto la sua famosa esperienza.
- I primi modelli planetari di Nagaoka. Agli inizi del XX secolo, Hantaro Nagaoka propose modelli di nuclei atomici simili al pianeta Saturno. In essi attorno ad un piccolo kernel, carica positiva, gli elettroni vengono combinati nella filatura ad anello. Queste versioni, come pure quelle precedenti, si sono rivelate errate.
- Modelli planetari di Bohr-Rutherford. Dopo diversi esperimenti, Ernest Rutherford suggerì che l'atomo è simile al sistema planetario. In esso, gli elettroni si muovono in orbite attorno al nucleo, che viene caricato positivamente e si trova al centro. Ma l'elettrodinamica classica ha contraddetto questo, perché, secondo esso, l'elettrone, muovendosi, irradia onde elettromagnetiche, e quindi perde energia. Bohr introdusse speciali postulati su cui gli elettroni non irradiavano energia mentre si trovavano in alcuni stati specifici. Risultò che la meccanica classica non era in grado di descrivere questi modelli della struttura dell'atomo. Questo in seguito ha portato all'emergere della meccanica quantistica, che rende possibile spiegare sia questo fenomeno che molti altri.
Modello quantum-meccanico di un atomo

Questo modello è lo sviluppo del precedente. Il modello quantomeccanico dell'atomo presuppone che i neutroni e i protoni caricati positivamente si trovino nel nucleo dell'atomo. Attorno ad esso si trovano elettroni caricati negativamente. Ma nella meccanica quantistica, gli elettroni non si muovono lungo traiettorie predeterminate, così nel 1927 W. Heisenberg espresse il principio di incertezza, secondo il quale sembra impossibile determinare accuratamente la coordinata di una particella e la sua velocità o quantità di moto.
Le proprietà chimiche degli elettroni sono determinate dal loroshell. Nella tavola periodica, gli atomi sono disposti secondo le cariche elettriche dei nuclei (stiamo parlando del numero di protoni), mentre i neutroni non influenzano le proprietà chimiche. Il modello quantomeccanico dell'atomo ha dimostrato che la sua massa principale è nel nucleo, mentre la frazione di elettroni rimane insignificante. È misurato in unità atomiche di massa, che è uguale a 1/12 della massa dell'atomo isotopico di carbonio di C12.
Funzione d'onda e orbitale

Secondo il principio di B. Geyzentberg, non si può dire con assoluta certezza che un elettrone che ha una certa velocità si trovi in un particolare punto dello spazio. Per descrivere le proprietà degli elettroni, usa la funzione d'onda di psi.
La probabilità di rilevare una particella in un particolareil tempo è direttamente proporzionale al quadrato del suo modulo, che viene calcolato per un certo tempo. Psi nel quadrato è chiamato densità di probabilità, che caratterizza gli elettroni attorno al nucleo sotto forma di una nuvola di elettroni. Più è grande, la probabilità di un elettrone in un certo spazio atomico sarà più alta.
Per una migliore comprensione, si può immaginarefotografie sovrapposte l'una sull'altra, dove le posizioni degli elettroni sono fisse in momenti diversi. Nel punto in cui i punti saranno più grandi e la nuvola diventerà la più densa e la probabilità di trovare l'elettrone è la più alta.
Si calcola, ad esempio, che il modello quantomeccanico dell'atomo di idrogeno includa la maggiore densità della nube di elettroni situata ad una distanza di 0,053 nanometri dal nucleo.
L'orbita della meccanica classica è stata sostituita danube di elettroni quantici. La funzione d'onda dell'elettrone psi qui è chiamata orbitale, che è caratterizzata dalla forma e dall'energia della nuvola di elettroni nello spazio. Con riferimento a un atomo, intendiamo lo spazio attorno al nucleo, nel quale è più probabile trovare l'elettrone.
Impossibile è possibile?

Come tutta la teoria, il modello quantomeccanicola struttura dell'atomo ha fatto una vera rivoluzione nel mondo scientifico e tra gli abitanti. Dopotutto, e fino ad oggi è difficile immaginare che la stessa particella allo stesso tempo non possa essere nello stesso posto nello stesso momento, ma in posti diversi! Per proteggere gli schemi stabiliti, si dice che nel microcosmo ci sono eventi impensabili e non lo sono nel macrocosmo. Ma è davvero così? O le persone hanno solo paura di ammettere la possibilità che "una goccia è come l'oceano e l'oceano è una goccia"?
</ p>